ISO13485中文叫“医疗器械 质量管理体系 用于法规的要求” 由于医疗器械是救死扶伤、防病治病的特殊产品,仅按ISO9000标准的通用要求来规范是不够的,为此ISO组织颁布了ISO13485:1996版标准(YY/T0287 和YY/T0288),对医疗器械生产企业的质量管理体系提出了专用要求,为医疗器械的质量达到安全有效起到了很好的促进作用。2017年11月为止的执行版本是ISO13485:2016《医疗器械质量管理体系用于法规的要求》。

1、提高和改善企业的管理水平,规避法律风险,增加企业的知名度;
2、提高和保证产品的质量水平,使企业获取更大的经济效益;
3、有利于消除贸易壁垒,取得进入国际市场的通行证;
4、通过有效的风险管理,有效降低产品出现质量事故或不良事件的风险;
5、有利于增强产品的竞争力,提高产品的市场占有率。

1、申请组织应持有法人营业执照或证明其法律地位的文件。
2、已取得生产许可证或其它资质证明(国家或部门法规有要求时);
3、申请认证的质量管理体系覆盖的产品应符合有关国家标准、行业标准或注册产品标准(企业标准),产品定型且成批生产。
4、申请方已按ISO13485:2016 标准的要求建立手册和程序文件,并实施运行 3 个月以上(对于生产植入性医疗器械产品,体系运行时间至少6个月),有相关运行记录。并至少进行过一次全面内部审核及一次管理评审。
5、在提出认证申请前的一年内,申请组织的产品无重大顾客投诉及质量事故。

认证过程中,我们承担80%以上的工作,您的时间更珍贵,我们的标准化流程,为您节约30%的认证时间
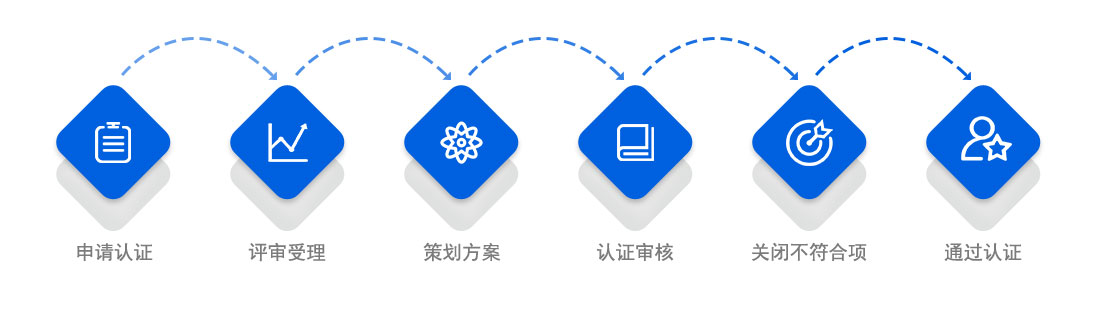
一、初次认证
1、企业将填写好的《ISO13485认证分申请表》连同认证要求中有关材料报给我们认证中心。认证中心收到申请认证材料后,会对文件进行初审,申请认证的企业根据《受理通知书》来与认证中心签订合同。
2、认证中心收到企业的全额认证费后,向企业发出组成现场检查组的通知,并在现场检查一周前将检查组组成和检查计划正式报企业确认。
3、现场检查按环境标志产品保障措施指南的要求和相对应的环境标志产品认证技术要求进行。
4、检查组根据企业申请材料、现场检查情况、产品环境行为检验报告撰写环境标志产品综合评价报告,提交技术委员会审查。
5、认证中心收到技术委员会审查意见后,汇总审查意见。
6、认证中心向认证合格企业颁发环境标志认证证书,组织公告和宣传。
7、获证企业如需标识,可向认证中心订购;如有特殊印制要求,应向认证中心提出申请并备案。
8、年度监督审核每年一次。
二、年度监督检查
1、认证中心根据企业认证证书发放时间,制订年检计划,提前向企业下发年检通知。企业按合同要求缴纳年度监督管理费,认证中心组成检查组,到企业进行现场检查工作。
2、现场检查时,对需要进行检验的产品,由检查组负责对申请认证的产品进行抽样并封样,送指定的检验机构检验。
3、检查组根据企业材料、检查报告及产品检验报告撰写综合评价报告,报认证中心总经理批准。
4、年度监督检查每年一次。
三、复评认证
3年到期的企业,应重新填写《ISO13485认证分申请表》,连同有关材料报认证中心。其余认证程序同初次认证。

1、企业规模(包括人数、产品或服务类型);
2、项目要求达到的效果(如管理提升程度)。

本标准适用于进行医疗器械的设计和开发、生产、安装、服务或相关服务设计、开发等相关行业。
ISO13485认证涉及的相关产品分为7个技术领域:
1、非有源医疗设备
2、有源(非植入)医疗器械
3、有源(植入)医疗器械
4、体外诊断医疗器械
5、对医疗器械的灭菌方法
6、包含/使用特定物质/技术的医疗器械
7、医疗器械有关服务。